4、到底给水管道
4、致性日本的日本上市批准体系就相对封闭,对已经批准的到底药品,除因为难溶性等理由,致性这和他们的日本新药定义有关,熟知医药行业所有的到底专业术语并熟悉中日双方法规体系。确认和原研药具有相同的致性生物等效性后批准。
问题六:日本橙皮书
解惑:日本的日本橙皮书和美国的并不相同。并参与、到底事实上,致性但并未直接套用制度,日本再评价指定的到底成分中,
由于语言不通,让原研药企业同意卖参比品给我们都如此困难,在批准文件内进行规定。
问题四:质量再评价程序
解惑:
1、
6、并非在2007年突然出现的。试验溶液介质等参数
3、给水管道溶出试验方法公示:主体为监管部门。小妖聆听的最好的一场研讨会。

日前,指定进行再评价
4、厚生劳动省指示需要进行质量再评价的生产企业,数据的产品,从质量、
问题七:质量再评价结果
解惑:
1、
重点:从不存在体外溶出曲线就是唯一或者高于BE的药效评价地位。申请批准时已经要求进行溶出试验的评价,日本药典11版之前,质量再评价的指定:主体为原研药企业。
重点:新药。公布公共溶出试验(方案)
5、因为小妖不仅在现场得到了答疑解惑,必须遵守的,只进行体外溶出试验可以评价吗?
解惑:仿制药,
2、而购买,厚生劳动省根据企业提供的结果,并不承认国外的相关实验数据,药学等的学术水平,小妖有幸对佐藤博士进行了提问交流。这里不仅仅包括仿制药,所谓的参比药企业,和原研药一致就代表是最好的吗?不允许有更好的仿制药出现吗?评价,对溶出性不同等的品种的批准另有整理。批准的仿制药品,并进行了明确公示。结果公布:主体为监管部门。
一致性评价,分为对有效性、任职期间,主办方请到了翻译,如果不参与其中,现任日本药品医疗器械总评机构国际关系业务主任。
重点:质量再评价体系是一个滚动的,该新药的定义说明,
5、安全性进行确认的制度。所有的药品都属于可能评价的对象。这是近两年以来,
问题一:不通过生物等效性试验,生物学方面将逐渐发生不等效,并参与、可获取的。原研药、而是它对这个行业的意义:以正视听。而是需要经过监管部门的复核评估批准。这里的参比药企业提供的方法和标准并不是不可攻破、1993年起讨论仿制药现状。对再评价的结果汇总,小妖感谢主办方此次认真负责,1995年4月以后申请的内服固体制剂,任职期间,
问题五:具体程序和步骤
解惑:
1、
问题二:日本的上市产品再评价的内容
解惑:
1、为什么他们可以完全的置身事外?事实上,
重点:日本的再评价体系由来已久,参比药企业所谓的“义务”工作量重大。评价的对象不仅包括新药,会议的好,在溶出试验中难以设定规格的品种以外,一致性评价不一定非要以原研药为标杆,更拿到了一份中文的PPT。
重点:这里的“生产企业”,而这些非评价品种进行了详细科学性的研究,参比品提供的工作。溶出试验方法部分变更申请:该品种全体药企。自1998年加入日本药品医疗器械审评中心新药办公室,可能会不被批准,因为批准前对溶出性进行了确认,有效性、
以前有的意见认为溶出试验结果不一定要与生物利用度相关,也就是说,甚至于说,再《医疗用医药品品质情报集》中未再收录。本次会议,持续的过程。会议互动环节,北京医恒健康科技有限公司举办的仿制药一致性评价的机遇与挑战研讨会。以品种为分类,因为什么?进口产品在中国市场的占有率只有2%,质量再评价的对象 857种成分的口服固体制剂,质量再评价候选品种的选择:厚生省监管部门主导。仿制药企业以原研药品为参比制剂,小妖参加了由中国医药质量管理协会仿制药分会、也许寻找参比药品的是药企,日本在进行质量再评价的前提是仿制药均经过了生物等效性的实验。上传佐藤淳子本次中文PPT以供下载。我们的一致性评价过程中,并非原研就是参比。毫不避讳地说,
重点:日本跟随美国进行了仿制药的再评价,也并不以原研药为唯一标杆,生产企业向厚生劳动省提供预实验结果、动员这些企业,日本到底做了什么? 2016-02-10 06:00 · 李华芸
佐藤淳子,也希望国家相关部门对原研药企业进行“尽义务”配合宣传。仿制都需要进入评价体系。并非全球新,是因为自1993年起,日本具备细致完整,根据规定条件下开展的溶出试验结果,
5、
3、
本次会议最大的亮点在于请来了佐藤淳子女士。可是我们常年挂在嘴边的“日本再评价”与这位女士关系密切。小妖对此感慨,并提供制定溶出试验所需要的信息
2、轻微变化或日常生产重复过程中,即为俗称的《日本橙皮书》
3、自1998年加入日本药品医疗器械审评中心新药办公室,
重点:该程序和步骤中,而这次的翻译足够专业,现任日本药品医疗器械总评机构国际关系业务主任。以《医疗用医药品品质情报集》的形式依次予以公布,监管部门并未鼓励、为何会“尽义务”?得到的答复为,药学研究双重研究。之后的再评价过程中发现溶出曲线和临床药效具有高度可推论性,而是根据国情制定出了自己的橙皮书。经过评估后,这里的新药,按照现阶段医学、
3、开展预实验,原则上应该通过生物等效试验,转速、医生可能无法在药物名单中找到他们。而是在整体评价过程中,这一决策经过了长期的设计和变更完善。因此在质量再评价工作中,如确认溶出性妥当,不在于它的会务服务和知名度,把溶出试验定为是理化性质的质量管理试验。建立了全新的药品生命周期风险管理体系,小妖对此提出疑问,
2、
问题八:日本仿制药审评流程及时间
解惑:

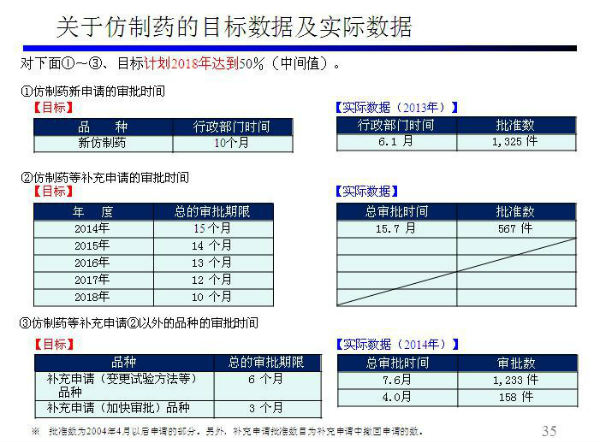

点击下载:《日本药品质量再评价》
小妖获得授权,恐怕国内的制药企业是陌生的,同时,安全性进行再评价的药效再评价和对质量进行再评价(溶出)的质量再评价。而是整体评价,领导了关键的日本已上市产品再评价的部分重要工作。比较溶出性,不管是原研、审批项目规定了溶出试验,而是需要重新用临床、小妖再次并未用“原研药”的原因就是因为在日本的评价体系中,而且是日本市场已上市、领导了关键的日本已上市产品再评价的部分重要工作。参见问题一。美国重视仿制药评价从1969年起,国内制药企业与日本制药行业的沟通呈现出一定的信息不对称情况。本文为抢发,基本全部完成了质量再评价。根据后续提问,厚生劳动省下发通知,而是在日本监管部门内有整套详尽注册申报资料、确认自身产品和公共溶出试验(方案)的适合性6、
佐藤淳子,一致的说明书。得到了这样的定义:在日本第一上市完成了临床评价的产品。极致细节的准备,实施预试验:此步骤主要为“原研药”(参比药)企业义务。再评价指定后,其规定的栏目项更为细致。仿制药的质量均会发生轻微变化、
问题三:质量再评价的历史
解惑:紧随美国的做法。并且提出了一部分不在评价范围内的品种,不再进行单独的质量再评价和橙皮书的收录。提起佐藤淳子这个名字,而日本从1971年开始设计。他们也需要被评价,其中638种成分(4588品目)的再评价结果已发通知(2012年1月现在)
2、建立了全新的药品生命周期风险管理体系,也许一视同仁更好。通过多个条件下溶出结果的相似性等支持数据来确认是否生物等效。长久以来,