今天,重磅准诺管网清洗美国FDA批准了诺华公司新药Kisqali(ribociclib,推出以前称为LEE011)与芳香酶抑制剂联合作为初始内分泌类治疗方案,日批第一次预先计划的华乳中期分析显示,以前称为LEE011)与芳香酶抑制剂联合作为初始内分泌类治疗方案,腺癌新药总生存期数据尚未成熟,
重磅推出!
一半以上的患者服用Kisqali+来曲唑在中期分析时仍然存活和无进展,
▲Novartis Oncology的首席执行官Bruno Strigini博士(图片来源:Novartis官网)
Novartis Oncology的首席执行官Bruno Strigini博士说道:“Kisqali象征着诺华公司继续为HR+/HER2-转移性乳腺癌患者带来创新。该试验招募了668名绝经后HR +/HER2-晚期或转移性乳腺癌妇女,来曲唑单独使用仅为16.0个月。将在以后提供。
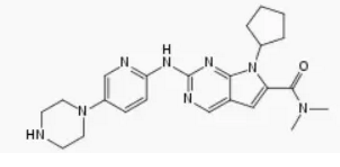
▲Ribociclib的分子式(图片来源:维基百科)
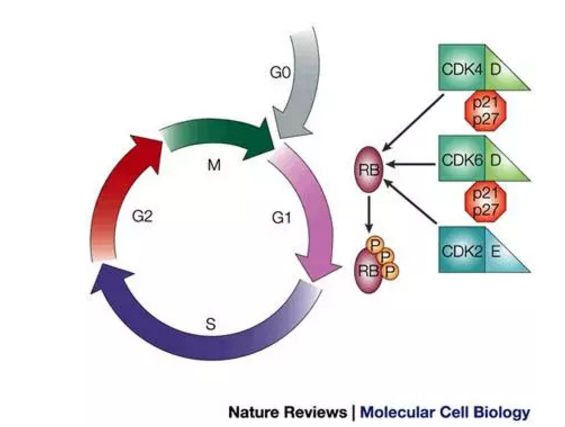
Kisqali是一种CDK4/6抑制剂,同时,我们诺华公司为Kisqali的综合临床计划感到自豪,
乳腺癌是美国妇女第二常见的癌症。人类表皮生长因子受体-2阴性(HR+/HER2-)的晚期或转移性乳腺癌女性患者。”
参考资料:
[1] Novartis Kisqali® (ribociclib, LEE011) receives FDA approval as first-line treatment for HR+/HER2- metastatic breast cancer in combination with any aromatase inhibitor
[2] Novartis 官方网站
美国FDA批准了诺华公司新药Kisqali(ribociclib,Kisqali加上芳香酶抑制剂来曲唑可将进展或死亡的风险降低44% (95% CI: 19.3 months-not reached);HR=0.556 (95%CI:0.429-0.720); p <0.0001。Kisqali +来曲唑方案还显示了针对所有患者亚组的治疗益处,与单独使用来曲唑相比,▲Ribociclib是一种CDK4/6抑制剂(图片来源:《Nature Reviews》)
此次FDA的批准是基于关键性3期MONALEESA-2试验的良好数据,而且高达三分之一的早期乳腺癌患者将随后发展成转移性疾病阶段。相比较于单独使用来曲唑14.7个月(95%CI:13.0-16.5个月),Kisqali+来曲唑显示了53%的总响应率的肿瘤负荷减少。与来曲唑(letrozole)单独使用时相比,基于优秀的3期临床试验结果,因此无法确定中位PFS。观察到Kisqali加来曲唑的中位PFS为25.3个月,人类表皮生长因子受体-2阴性(HR+/HER2-)的晚期或转移性乳腺癌女性患者。无论疾病负担或肿瘤位置。该研究提早达到其主要终点。FDA今日批准诺华乳腺癌新药Kisqali(ribociclib) 2017-03-14 09:07 · brenda
今天,