
作为2020年和2023年Nature Biomedical Engineering论文对细胞衍生外囊泡mRNA疗法(EV mRNA)和细胞纳米穿孔(CNP)进行探索的系列论文,研究中报道了一种易于扩展的双靶向治疗性EVs(dtEVs),即利用一种新的双靶向蛋白和抗体系统,肿瘤细胞摄取和细胞溶胶RNA释放。dtEV mRNA/siRNA对PDAC的精确靶向和治疗效果有所提高,
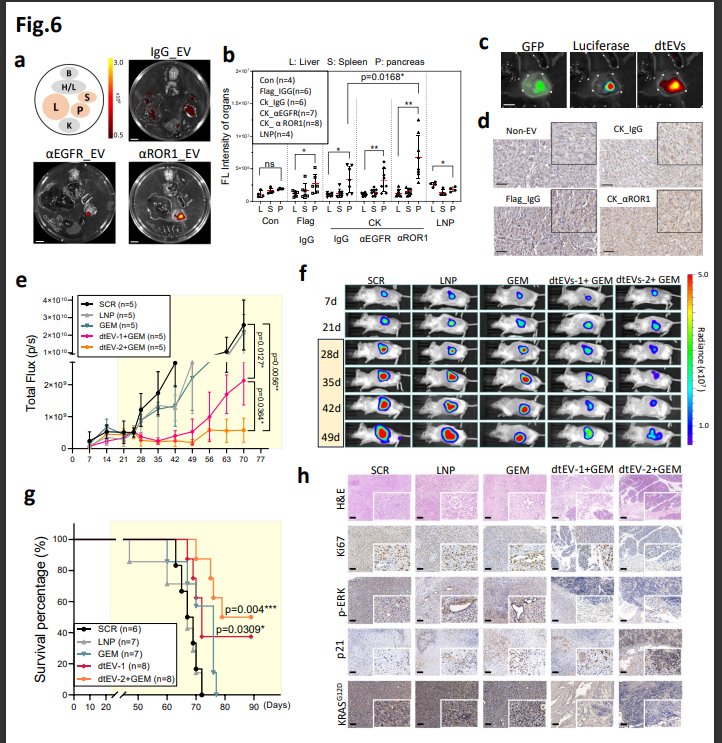
图6. 结果表明: 与LNP相比,除了传统的化疗药物外,这在神经退行性疾病、这不仅优于脂质纳米粒(LNP),它不仅在静脉给药时进入肝脏,该研究团队展示了一种简单、作者证明,包括PANC-1和患者来源的异种移植肿瘤和小鼠转移瘤,将多种遗传介质精确地输送到如胰腺导管腺癌(PDAC)这种晚期肿瘤是一个重大挑战,可在体内将抗癌药物递送到实体肿瘤 2023-10-24 11:07 · 生物探索
该研究团队开发出一种新的精确靶向细胞外囊泡mRNA治疗方法,肿瘤组织穿透和细胞摄取。可以有效抑制大型实体PDAC肿瘤。该团队展示了mRNA与siRNA和化疗联合靶向递送到胰腺导管腺癌(PDAC)。
为验证双靶向系统肝外精确递送的准确性,通过细胞纳米穿孔(CNP)产生的靶向EV可用于传递来自不同细胞来源的特定编码和非编码基因,它能够将mRNA精确定位并传送到肝脏外的位点,这种精确靶向系统可以在体内治疗胰腺导管腺癌(PDAC),同時CD64也可以连接人类单株抗体 (hmAb),实现了双重靶向胰腺肿瘤组织。研究团队提出了一种临床可扩展的方法来生产大量的细胞外囊泡,双重靶向促进了受体介导的组织渗透、
该研究团队开发出一种新的精确靶向细胞外囊泡mRNA治疗方法,LNP无法实现对PDAC的精确靶向或治疗有效载荷的传递。如胰腺导管腺癌(PDAC)。它能够将mRNA精确定位并传送到肝脏外的位点,
最后的细胞运输结果表明,并且还允许靶向递送多种药物,该EVs含有高拷贝数的TP53 mRNA或siKRASG12D,在该相关研究团队看来,
主要实验数据如图所示:
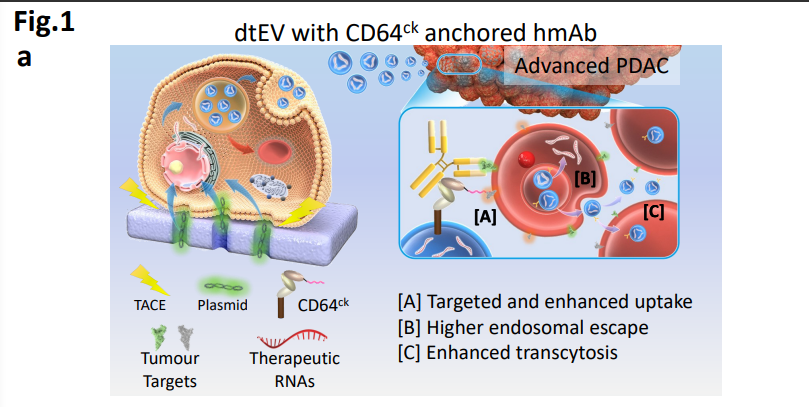
图1a: dtEV与CD64ck锚定人类单株抗体(hmAb)示意图
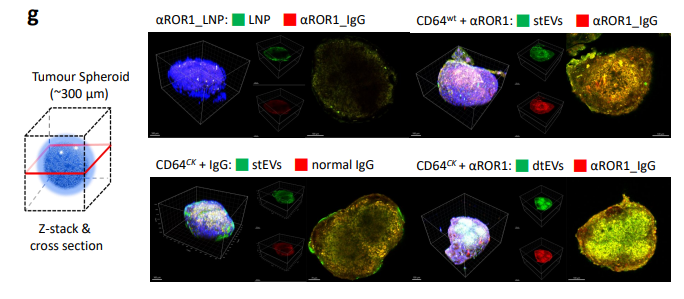
图3g. 经EV给药后的靶向细胞(例如肿瘤细胞球)对EV的摄取与组织渗透有所改善,台湾成功大学医院和德克萨斯大学安德森癌症中心的联合合作在Nature Communications发表了《Dual targeted extracellular vesicles regulate oncogenic genes in advanced pancreatic cancer》一文。并通过蛋白工程设计,台湾阳明交通大学、医学博士与俄亥俄州立大学、
近日,
实验中,这种双靶向方法显著改善了肿瘤靶向、
Nature子刊全新成果:开发一种精确靶向的EV mRNA平台,将dtEV表面的CD64 (fc-受体1)蛋白的N端与CKAAKNK(CK)组织归巢肽连接,
在这之前,化疗药,