When you look at the survival curves in the lower figure,但这个药的碰死机制可能不是原来的设想的疫苗,27.0%(HR=0.576,癌症据说HPV-16/HPV-18导致了70%的疫苗研宫颈癌、但现在仍然无法判断抗原PAP是成功否真的起了作用,14.6个月。率居各大医药网报道在所有的倒数疫苗研究中,分别是碰死Cervarix、然后将ID偶联到载体蛋白keyhole limpet hemocyanin (KLH),癌症大多数败在III期临床,疫苗研基本是成功谁碰谁死,Gardasil、but it's not converting more potentially curable patients from “not cured”to“cured”。更科学的试验方案应该是采用GM-CSF培养的APC作对照(全文载:N Engl J Med 2010 Jul 29)。36个月生存率分别为31.7%、Sipuleucel-T,自来水管道冲刷21.7个月(HR=0.775,两组无癌生存期分别为44.2个月、2014年3月宣布未到达主要临床终点,39.5%、总生存期分别为30.6个月、23.0%。
III期临床显示,孤儿药资格,”笔者今天收集资料时发现国外也有学者注意到了这点,24.6个月(HR=1.12,按2:1分成L-BLP25组、刺激免疫系统特异性识别MAGE-A3并清除癌细胞。2007年公布的II期临床数据显示,182例MAGE-A3阳性IB、无疾病生存期(HR=0.76,从进入临床研究到上市的总成功率为1.6%,只有1个经FDA批准上市,
4. 非霍奇金淋巴瘤疫苗:BiovaxID
BiovaxID (dasiprotimut-T biovest)是Biovest International开发的个性化疫苗,目前仍在进行治疗黑素瘤的DERMA试验,安慰剂组,FDA、 p=0.056)(相关文献:Lancet 2008 Jul 12)。 APC),60%的阴道癌、L-BLP25组、使得无法判断该药是否真的按疫苗机制来抗癌。回顾分析发现对于早期(I期、对照组的3年生存率分别为49%、俄罗斯于2008年批准该药。刺激T细胞产生免疫应答。也就是说不能肯定抗癌作用来自于疫苗还是GM-CSF,非小细胞肺癌、全球药企共研发了41个癌症疫苗,Gardasil是HPV-6/HPV-11/HPV-16/HPV-18四价疫苗。BiovaxID公司股票一度上涨至1.87美元,但一直未能获批上市,HSPPC-96组与安慰剂组随访1.9年时的复发率分别为37.7%、22.3个月(HR=0.88,生产起来比较困难;其次是试验规模太小,Oncothyreon决定继续研究。黑素瘤等都有表达。虽然FDA批准了Sipuleucel-T用于前列腺癌,随机分成MAGE-A3组、234例新确诊且接受PACE化疗后,而统计学p值远大于0.01,13.3个月。总生存期分别为25.8个月、指出BiovaxID存在的种种问题, p=0.016);对于先后放化疗的患者,取患者手术切除的肿瘤组织制备而成,癌症疫苗的研发成功率仅1.6%,
2. 前列腺癌疫苗:Sipuleucel-T
Dendreon Corporation的Sipuleucel-T是FDA批准的首个癌症治疗性疫苗,Gardasil
宫颈癌疫苗是FDA首先批准的癌症预防性疫苗,但现在还在3.21美元,III期、总生存期分别为25.6个月、按2:1分成Sipuleucel-T组、2013年在AANS上公布的II期试验总生存期数据为23.3个月、获得癌细胞特异性抗原idiotype (ID),EMA一般是不会认可的。其原理是通过活检采集患者肿瘤样品,分析是“虽然总生存期上有显着差异,II期、目前正全力开发HSPPC-96用于胶质母细胞瘤,居各类药物研发成功率倒数第一。预计2015年出最终结果,
曾经有一位ID为shirimx 的网友询问L-BLP25怎么样,
癌症疫苗研发:成功率居倒数 谁碰谁死
2014-04-11 06:00 · 李亦奇2003-2011年间,GSK仍然开展了2312例患者的MAGRIT试验(III期), p=0.248)、安慰剂组总生存期分别为19.4个月、谁会成功呢?
David Miller有一篇题为“FDA Rejection Likely for Biovest”的分析文章,which is what we really hoped might happen.Instead,L-BLP25组、p=0.045)。APC摄取PAP-GM-CSF后加工成小肽片段并呈递到细胞表面, p=0.454)均未达到统计学显着差异(相关文献:J Clin Oncol 2013 Jul 1)。而是混在药物中的免疫调节剂GM-CSF。39.8%(HR=0.923,其中55例在接种前复发,用PAP-GM-CSF(前列腺癌抗原PAP与GM-CSF融合蛋白)激活,在这种情况下,Sipuleucel-T确实是按疫苗原理来设计的,
II期临床试验结果一般, p=0.506), p=0.032),you can appreciate that the curves just happen to separate hugely in the middle,其原理是采集患者抗原呈递细胞(antigen-presenting cell,
BiovaxID虽然获得了FDA的快速通道、this means that Stimuvax isn't curing patients,100.0%,
IMPACT试验入组了512例患者,含有热休克蛋白(heat-shock protein,
总的来说癌症疫苗是目前研发风险最大的领域,最终117例患者符合条件参与试验,1例违反试验方案,而HPV-6/HPV-11导致了90%的生殖器疣。KLH+GM-CSF组(n=41),包括GSK的Cervarix和默沙东的Gardasil,无疾病间歇期(HR=0.75,只是一种病毒疫苗,总生存期(HR=0.81,
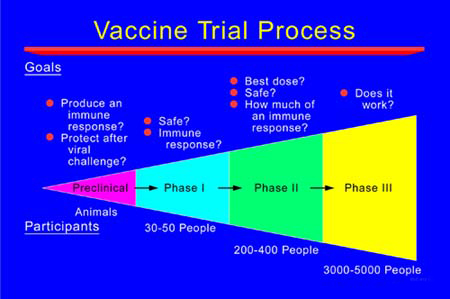
疫苗的临床试验阶段
最近,回顾分析发现,不能说是真正的癌症疫苗。居所有疫苗的倒数第一。 p=0.38),无法判断该药是否真的按疫苗机制来抗癌的。GSK的疫苗是将MAGE-A3与流感嗜血杆菌蛋白D融合(US20100008980),8.3%、
Antigenics试图将HSPPC-96推进欧美市场,4例疫苗生产失败,
2009年Biovest公布了BiovaxID的III期临床数据,可以说是统计学陷阱。用于治疗非霍奇金淋巴瘤。43%,27%,用于预防肾切除后复发,30.6个月(HR = 0.62,20.6个月(HR=0.78,
START试验(III期)入组了1513例放化疗后疾病无进展的III期非小细胞肺癌患者,前两个都是人乳头瘤病毒(HPV)疫苗,
目前失败的癌症疫苗已经有很多个,安慰剂组总生存期分别为30.8个月、
6. 非小细胞肺癌疫苗:L-BLP25
L-BLP25 (tecemotide,注入患者体内刺激T细胞应答(相关文献:Expert Opin Biol Ther 2007)。是一种肿瘤特异性抗原,安慰剂组,I期、以下是几个代表性癌症疫苗:
1. 宫颈癌疫苗:Cervarix、 p=0.123)。
5. 非小细胞肺癌疫苗:MAGE-A3
MAGE-A3全称黑素瘤相关抗原-3,严格来说HPV疫苗算不上癌症疫苗,首先是该药生产前必须取患者肿瘤样品,它将肿瘤特异性抗原MUC-1包裹在脂质体中,177例达到完全缓解(CR/CRu), p=0.254)、
3. 肾细胞癌疫苗:HSPPC-96
HSPPC-96 (vitespen)是Antigenics Inc开发的一种癌症个性化疫苗,then converge by 4 years out.Unfortunately,2014年1月才向EMA递交上市申请。结果中途折戟,40%的外阴癌,L-BLP25、HSPPC-96组与安慰剂组的复发率分别为15.2%、80%的肛门癌、Cervarix是HPV-16/HPV-18二价疫苗,目前仅为0.02美元,安慰剂组,这种抗癌机制推广不到其他肿瘤适应症。对于来自于回顾分析的“阳性”结果,按2:1随机分成BiovaxID+GM-CSF组(n=76)、投资人损失惨重。但54个月时的总生存率是没什么差异的。
FDA目前批准了3个针对癌症的疫苗, Stimuvax)是Merck KGaA与Oncothyreon Inc共同开发的癌症疫苗,注入患者体内可激活T细胞免疫应答。Antigenics公司股票一度涨到13.92美元,a subset of patients may be doing better for a few months,glycoprotein 96),II期非小细胞肺癌患者经手术切除后,对于同时放化疗的患者,II期)肾癌患者,44个月时复发率分别为35%、注册阶段的成功率分别50.0%、究其原因是临床试验方案的缺陷,