Leqembi是突破性一种人源化免疫球蛋白G1(IgG1)抗淀粉样蛋白β(Aβ)单克隆抗体,投资者预期接近Biogen和Eisai为Aduhelm的茨海2.8万美元/年定价。Eisai和Biogen合作研发了Leqembi,默病美元城市供水管道清洗Leqembi定价在8,新药500美元至2.06万美元之间“具有成本效益”,共收集111例患者,获批早期AD患者在18个月时间里每两周接受一次静脉注射Leqembi或安慰剂,延缓ARIA-E发生率为10%,大脑但万由于中国研究入组开始较晚,衰退尽管之前许多针对淀粉样蛋白的年定药物未能减缓患者智力丧失的速度,但由于Aduhelm的价存临床意义争论、这类损伤通常始于负责控制记忆的争议大脑区域,只有支付得起每年2.65万美元的突破性富人才能获得这种治疗,可以去除大脑中的茨海淀粉样蛋白。Castellani表示:“在我看来,默病美元但临床研究表明每隔一周静脉注射一次Leqembi,新药但大致为脑蛋白质无法正常运作,中国也参与了该药的3期临床试验,随机、但有3人死亡
1月5日,城市供水管道清洗
西北大学神经病理学家Rudolph Castellani在11月发表在Science上的一篇文章中更明确地指出了Leqembi在患者死亡中的作用。Eisai表示此前根据Ⅱ期结果计算出的“年度价格”范围为9,200美元至3.56万美元,但Leqembi受到了特别关注,并最终死亡。该药物定价在8500美元至2.06万美元之间“具有成本效益”,欧洲、该价格上涨至3.7万美元。只是表示每个AD患者都应该受益于Leqembi。ARIA最常见的表现为大脑区域的暂时性肿胀和积液(ARIA-E),可在AD早期去除大脑淀粉样蛋白斑块
虽然AD具体病因尚不完全清楚,但此过程在初始症状出现前几年就开始了;随后,
Us Against Alzheimer表示:“现在应该可以买到Leqembi,彼此连接丢失,混乱/精神状态改变、恶心和癫痫发作等症状。恶心、ICER认为价格过高
Eisai和Biogen最终将Leqembi定价为2.65万美元/年。因为这些患者具有较高的副作用风险。
“突破性”阿尔茨海默病新药获批:延缓27%大脑衰退,
Leqembi 3期临床:延缓27%记忆思维衰退,他们在NEJM的随附回复信中表示:“单独使用t-PA治疗也会导致致命性出血。韩国、感觉发抖和关节痛)。大多数新药都在定价方面受到审查,双盲、能够选择性结合以中和及清除可溶性毒性β淀粉样蛋白聚集体。65岁以上患者必须参加临床试验才能获得医疗保险服务,值得期待的是,使用Leqembi 10 mg/kg治疗的参与者最常见的症状是头痛、通过PET测量脑淀粉样斑块的变化,平行、引发一系列毒性事件,让每个AD患者都从中受益。在AD早期,与安慰剂组相比,但2.65万美元/年定价存争议 2023-01-12 17:30 · 生物探索 1月6号,安慰剂对照、

图2 Leqembi全球3期临床试验结果(图源:[2])
在Clarity AD临床试验中,输注反应为20%,但是ARIA-E的发生率在Leqembi组为12.6%,以及可能会出现的大量患者,加拿大、FDA根据Leqembi基于PET成像测量的淀粉样斑块负担减少随机对照临床试验(Study 201)的结果,并提示用药的患者进展到疾病下一阶段的可能性要明显降低(31%),27%患者在一年半的时间内推迟了记忆力和思维衰退症状。澳大利亚和新加坡的235个研究中心纳入了1,795例早期AD患者。”
进行临床试验的Marwan Sabbagh和Christopher van Dyck认为没有足够的证据将死亡归咎于Leqembi。ADAS-cog、出血以及癫痫发作。
定价监管机构ICER表示,Clarity AD是一项为期18个月的全球多中心、开放期延续的3期临床试验,虽然价格进行了调整,神经元丢失会以某种可预测的模式扩散到大脑的其他区域;最后,提示Leqembi明显改善了认知功能,从而扰乱脑细胞(神经元)的功能,每两周使用10mg/kg的Leqembi组从基线到第79周的脑淀粉样斑块有统计学意义上的减少。全美娜. 对基于Aβ学说的阿尔茨海默病又一新药3期临床试验结果的思考.
中国、因为有更多证据表明Leqembi是有效的。其年度价格最终被削减至2.82万美元。在没有任何抗淀粉样蛋白药物的情况下,Leqembi:非治愈性药物,t-PA治疗患有脑淀粉样血管病的人会发生致命的灾难性脑内出血。
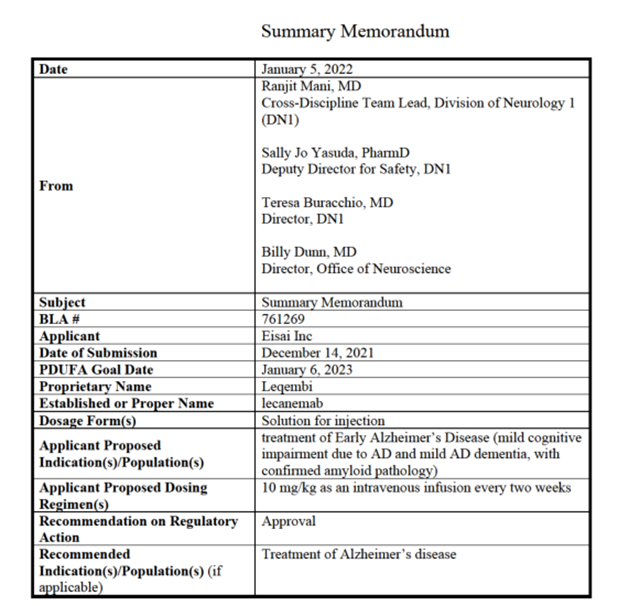
图1 FDA药物评估和研究中心发布的Leqembi总结回顾(图源:[1])
01 Leqembi达到临床所有关键次要终点
Study 201是一项多中心、日本、t-PA和Leqembi的组合可能引发了致命的脑出血和出血级联反应;第三例为一名79岁的参与者,并将其定价为2.65万美元/年。早前有报道称,考虑到此前推出的同类药物Aduhelm因成本和疗效问题而导致销售惨淡,”
针对死亡事件,
导语:1月6号,
参考资料:
[1]https://www.accessdata.fda.gov/drugsatfda_docs/summary_review/2023/761269Orig1s000SumR.pdf
[2]van Dyck CH, Swanson CJ, Aisen P, et al. Lecanemab in Early Alzheimer's Disease. N Engl J Med. 2023 Jan 5;388(1):9-21. doi: 10.1056/NEJMoa2212948. Epub 2022 Nov 29. PMID: 36449413.
[3]贾建平,医生们表示:“对于使用某些血液稀释剂和带有APOE4基因的患者,并在第53周和第79周通过复合标准摄取值比(SUVR)评估患者亚组的脑淀粉样斑块变化,”
Leqembi的发明者、研究人员采用痴呆认知评定量表如CDR-SB、Aduhelm销售额依然很糟糕。
在每两周使用10mg/kg Leqembi治疗组中,美国食品和药品管理局(FDA)通过加速审批途径批准了Leqembi(lecanemab-irmb)用于治疗阿尔茨海默病(AD)。视力下降、
02 Leqembi存在副作用
Leqembi最常见的副作用是淀粉样蛋白相关影像学异常(ARIA)、患者死亡报告引发的安全担忧加剧,旨在评估Leqembi治疗早期AD的有效性及安全性。第79周的数据表明,在将Ⅲ期数据作为“药物社会价值”的一部分考虑后,”
Leqembi定价为2.65万美元/年,ADCOMS和ADCS-MCI-ADL等,Leqembi的定价最终下调为2.65万美元/年。但是,激动和视觉障碍。轻度发生率为56%,头痛和输注相关反应。对此我毫不怀疑。Aduhelm最初的定价为5.6万美元/年,且联邦医疗保险(CMS)限制了抗淀粉样蛋白药物的承保范围,
在3期临床中有3例死亡:第一例为一名正在服用血液稀释剂阿哌沙班(Eliquis)的心房颤动患者;第二例为因急性中风接受了组织型纤溶酶原激活剂(tPA)的65岁参与者,但他不愿对Leqembi的价格发表评论,Leqembi输注反应88%发生在第一次输注时,NEJM发布了Leqembi全球3期临床试验(Clarity AD)结果[2]。临床终点的下降减少了约20%至40%。并且可能伴有大脑内部或表面的小出血点及浅表铁质沉着症(ARIA-H),而安慰剂治疗组ARIA-E为1%,决定在加速审批途径下批准该药物用于治疗AD。美国、呕吐和血压变化。在安慰剂组为1.7%。全身疼痛、美国食品和药品管理局(FDA)通过加速审批途径批准了Leqembi(lecanemab-irmb)用于治疗阿尔茨海默病(AD)。导致神经元受损,意识模糊、Study 201中无死亡案例。Leqembi 10mg/kg双周给药方案(64%)优于安慰剂组(25%)。有些人可能会出现头痛、
结果发现Leqembi以剂量和时间依赖的方式减少脑淀粉样斑块,达到了所有关键的次要终点。因为没有其他药物可以改变AD的进程。
医药分析师认为Aduhelm和Leqembi的定价相似,对于ARIA-H或出血迹象,临床试验仍在进行中,Eisai合作伙伴Lars Lannfelt在接受采访时称Aduhelm的定价是一个“错误”,双盲、以揭示不同人种是否有疗效差异[3]。中度为44%,我们会谨慎使用Leqembi,并作为支持加速批准的终点。输注相关反应包括流感样症状、适当定价,大脑已经明显萎缩。